El fallo inmunológico de la microglía en la esclerosis múltiple promueve la neurodegeneración y el daño neuronal provoca la liberación de nuevos estímulos pro-inflamatorios que aumentan y perpetúan la respuesta neuroinmune.
Las células microgliales son conocidas como los macrófagos residentes del sistema central (SNC) y constituyen aproximadamente el 10% de las células nerviosas.
La microglía se encuentra constantemente removiendo desechos celulares y detectando patógenos en el SNC.
Al activarse en respuesta a lesiones, inflamación o infecciones, cambia su aspecto morfológico y aumenta la expresión de marcadores de superficie típicamente asociados a macrófagos.
Los macrófagos son células del sistema inmune cuya función principal es eliminar mediante fagocitosis todos los elementos extraños que se introducen en el organismo, por ejemplo: bacterias y sustancias de desecho de los tejidos.
También te puede interesar leer: Respuesta T en la esclerosis múltiple, ¿fallo inmunológico?
¿Qué funciones lleva a cabo la microglía?
Se han propuesto varias funciones in vivo para este tipo celular, entre ellas se encuentra la pro y la anti-inflamación.
Que se desencadene una función u otra no es un evento aleatorio, es decir, el estímulo involucrado es el que determina el fenotipo funcional que toma la microglía luego de su activación:
- fenotipo M1: pro-inflamatorio
- fenotipo M2: anti-inflamatorio (asociado a la remodelación de tejidos y cicatrización).

Microglía en la esclerosis múltiple
En los estadios tempranos de la esclerosis múltiple (EM) pueden ser identificados en las lesiones con daño axonal y neuronal grupos de células microgliales activadas y macrófagos periféricos reclutados al SNC.
La microglía y los macrófagos son activados por sustancias producidas por las células T y también por productos de la degradación de mielina.
La activación de células microgliales y macrófagos resulta en la producción de otras sustancias (citoquinas, quimiocinas y metabolitos) que regulan directa e indirectamente la neurodegeneración en la EM.
Por ejemplo:
- La quimiocina conocida como CCL-2 producida por la microglía activada, afecta la integridad de la barrera hematoencefálica y atrae macrófagos periféricos al SNC.
- El factor de necrosis tumoral alfa (TNFα) induce apoptosis (muerte) en neuronas y también actúa en forma autocrina (sobre la misma microglía) para promover la secreción de glutamato, incrementando la muerte neuronal causada por excitotoxicidad.
- La interleucina 1 beta (IL-1β) también tiene actividades neurotóxicas, e induce la producción de óxido nítrico, que junto con las especies reactivas del oxígeno favorece la neurotoxicidad.
- Los macrófagos ya reclutados al SNC, pueden adquirir también un fenotipo pro-inflamatorio (M1) que promueve la neurodegeneración.
También te puede interesar leer: Proteína ligera de los neurofilamentos, ¿cuál es su relación con la neurodegeneración?
Ejemplos de células microgliales involucradas en la esclerosis múltiple
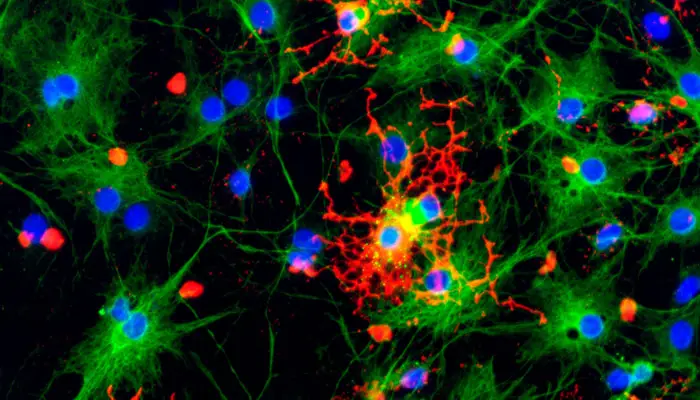
Astrocitos, tipo celular que resulta dañado
Constituyen el más abundante y diverso tipo de células de la glía en el SNC y llevan a cabo importantes funciones metabólicas e inmunológicas.
Los astrocitos presentan un daño significativo en lesiones activas en la EM; este daño sugiere que las disfunciones en la barrera hematoencefálica que caracterizan la enfermedad están asociadas a defectos en la funcionalidad de este tipo celular.
Finalmente, estas células regulan la actividad de otras que también están involucradas en la inmunopatología de la EM, como son: oligodendrocitos, células T y células B.
Oligodendrocitos, parte de una potencial estrategia terapéutica
Los oligodendrocitos son células de la glía que controlan la producción y mantenimiento de la mielina en el SNC.
Se diferencian a partir de las células precursoras de oligodendrocitos (CPO) durante las primeras etapas del desarrollo, aunque estos precursores mantienen su capacidad de diferenciación en el SNC adulto.
De hecho, las CPO proliferan y se diferencian frente a distintos estímulos tóxicos, traumáticos o inflamatorios, pero esta capacidad se pierde gradualmente durante el envejecimiento.
Una potencial estrategia terapéutica para promover la remielinización en la EM, detener y revertir la disfunción neurológica, es la regulación de las diversas vías de señalización que intervienen en la diferenciación de las CPO.
Estas observaciones sugieren que el tratamiento efectivo de los pacientes con EM requiere el control tanto del componente neurodegenerativo como del componente inflamatorio de la enfermedad.
Las intervenciones terapéuticas disponibles en la actualidad modulan principalmente los aspectos inmunológicos de la enfermedad y dentro de ellos solo aquellos relacionados con la respuesta inmune adaptativa (células B y T).
Uno de los retos de las nuevas terapias de la EM es controlar los componentes innatos del sistema inmune (microglía, macrófagos, astrocitos) y promover así la remielinización.
También te puede interesar leer: Microglía, sus funciones dentro del sistema neuroinmune
Bibliografía
Brosnan CF, R. C. (2013). The astrocyte in multiple sclerosis revisited. . Glia 61, 453-465.
Francisco J. Quintana, S. P.-S. (2014). Inmunopatología de la Esclerosis Múltiple. Medicina (Buenos Aires), 404-410.
Mantovani A, B. S. (2013). Macrophage plasticity and polarization in tissue repair and remodelling. . J Pathology 229, 176-185.
Singh S, M. I. (2013). Microglial nodules in early multiple sclerosis white matter are associated with degenerating axons. . Acta Neuropathol 125, 595-608.