La degradación dirigida de proteínas es una estrategia farmacológica que influye en el medio natural de la célula para eliminar las proteínas dañadas o no deseadas. Su característica más importante es que destruyen a las proteínas sobre las que actúan, en vez de inhibirlas como hacen otros fármacos.

Existen muchos tipos de degradadores de proteínas, uno de ellos es el conocido como quimeras dirigidas a la proteólisis. La sigla PROTACs, se debe a su traducción del inglés: proteolysis-targeting chimeras.
Estas moléculas son grandes (llegan a los 1000 daltons), al contrario de los fármacos más comunes que tiene una masa de menos de 500 daltons. No obstante, con esa característica los POTRACs logran entrar en las células y cumplir sus funciones.
Tienen dos elementos muy importantes a su favor: destruyen las proteínas en lugar de inhibirlas y pueden unirse a ellas donde otros medicamentos no pueden hacerlo.
Por esta razón constituyen promesas para perseguir objetivos moleculares “complicados”, por ejemplo: los genes MYC (familia de protooncogenes claves para la progresión del cáncer) o la proteína tau involucrada en la enfermedad de Alzheimer.
Conozcamos entonces un poco más sobre estas impresionantes moléculas.
También te puede interesar leer: La proteína tau: qué es y cómo influye en la neurodegeneración
¿Cómo funcionan los PROTACs?
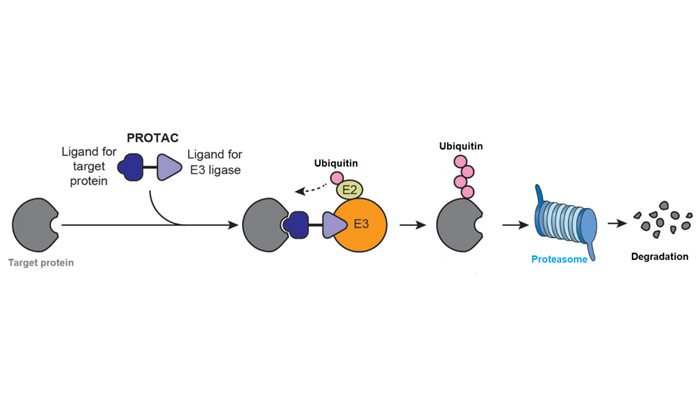
Los PROTACs poseen dos extremos de unión a los cuales se unen las proteínas involucradas en su mecanismo de acción.
A un extremo se une la proteína a eliminar, mientras que en el otro una ubiquitina ligasa (esta forma parte del sistema natural de eliminación de la célula).
Esta ligasa marca a las moléculas defectuosas o dañadas mediante la unión de otra proteína llamada ubiquitina.
Lo que sucede es que la unión de ubiquitina funciona como una señal de “destrucción” que ordena al sistema de degradación (llamado proteosoma) que haga su trabajo.
¿Se necesitaría una gran o pequeña cantidad de estas moléculas?
Que las proteínas interactuantes estén próximas en el espacio explica muchas cosas en el campo de la bioquímica.
De ahí que tener a una ligasa y a la proteína que se quiere degradar unidas a través de un PROTAC, constituye un elemento suficiente para que esta última quede marcada y se degrade.
Las ligasas son proteínas muy eficientes y en el interior celular existe una alta concentración de ubiquitina. Y además, el PROTAC queda libre luego de ejercer su función de degradación.
Se piensa que una sola molécula PROTAC debe poder realizar repetidos ciclos de captura/degradación y que por tanto se necesite una pequeña cantidad de dicho medicamento para lograr una actividad potente.
También te puede interesar leer: Microglía, la otra cara de sus funciones inmunes en la esclerosis múltiple
Un candidato en fase clínica
Se espera comience a mediados de 2019, incluirá entre 28 y 36 hombres con cáncer de próstata metastásico y durará alrededor de 9 meses.
Después de contar con información suficiente sobre la biología y toxicología, este primer candidato se empleará contra el receptor de andrógenos, una proteína que figura como diana de un número importante de medicamentos ya aprobados.
La compañía dueña de la molécula espera que al degradar el receptor, en lugar de inhibir, su PROTAC pueda tratar a las personas donde se ha visto resistencia o que no hayan visto ningún beneficio con los medicamentos existentes.
También te puede interesar leer: Dopamina, pieza clave del sistema mesolímbico y en las adicciones
Bibliografía
Lu M, L. T. (2018). Discovery of a Keap1-dependent peptide PROTAC to knockdown Tau by ubiquitination-proteasome degradation pathway. Eur J Med Chem. 146, 251-259 .
Scudellari, M. (2019). The protein slayers. An emerging class of drug could send some of medicine´s most troublesome protein targets to the cellular rubbish bin. Nature 567,, 298-300.
Taavi Neklesa, L. B. (2018). An androgen receptor PROTAC degrader for prostate cancer. Cancer Res 78 (13), Abstract nr 5236.