Esta terapia celular para la esclerosis lateral amiotrófica persigue mejorar la supervivencia de las neuronas motoras. Los ensayos anteriores reflejan una ralentización de la progresión a la que avanza la enfermedad.
Alrededor de 200 personas con esclerosis lateral amitrófica (ELA) participarán en el ensayo clínico de fase III que ha iniciado la compañía israelí Brainstorm Cell Therapeutics en territorio estadounidense.
Según informa ALS Research Forum, el ensayo probará la eficacia de una terapia con células madre patentada por la compañía y que ha denominado NurOwn.
Los participantes en la investigación recibirán por inyección intratecal células que secretan factores neurotróficos, con el objetivo de aumentar la supervivencia de las neuronas motoras que son prácticamente barridas por la enfermedad.
NurOwn, la terapia celular para la esclerosis lateral amiotrófica.
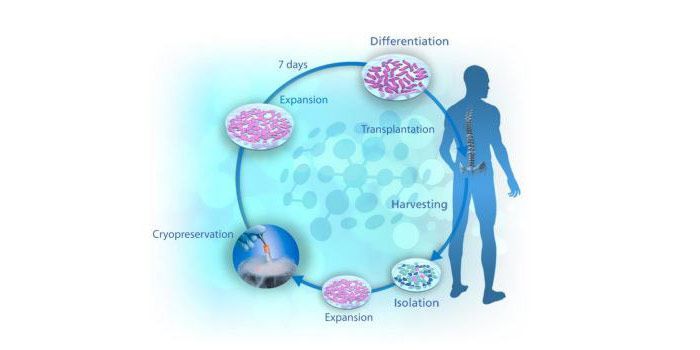
La idea fundamental que tenemos sobre las células madres es que sirven para crear tipos celulares específicos que sustituirán a las células dañadas por una enfermedad. En el caso de la esclerosis lateral amiotrófica el objetivo sería crear neuronas motoras para sustituir a las que mueren.
Pero, ¿qué tal si en primer lugar evitamos que las neuronas motoras mueran? Esa es la idea que hay de base en NurOwn, la terapia celular de Brainstorm Cell Therapeutics.
Usan las células madre obtenidas del propio paciente para crear lo que llaman “fábricas biológicas”; células capaces de producir factores neurotróficos. Estos últimos son proteínas que contribuyen a la supervivencia de las células.
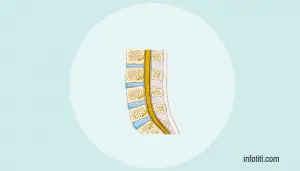
Una vez obtenidas las células madre mesenquimales de la médula ósea del paciente, estas son expandidas y criopreservadas. Posteriormente son inducidas a diferenciarse en células secretoras de factores neurotróficos que son trasplantadas en el espacio intratecal de la médula espinal.
La imagen anterior puede dar una idea general de todo el proceso.
También te puede interesar leer: No sin polémica, la FDA aprueba Radicava para el tratamiento de la esclerosis lateral amiotrófica (ELA).
¿Qué resultados se conocen de esta terapia celular para la ELA?

Hasta el momento se han realizado tres ensayos clínicos previos, de fase I/II y II. Dos de ellos en Israel, una potencia mundial en el campo de la biotecnología, y un tercero en EE.UU.
Una publicación en la revista JAMA Neurology del año 2016 presentó los resultados de los ensayos realizados en Israel. Los autores concluyeron que la terapia es segura y bien tolerada, sin que se hayan producidos eventos adversos de consideración.
En relación al impacto sobre la enfermedad también parece evidente que NurOwn logra enlentecer la tasa de progresión de la ELA (medida con la ALSFRS-R), un beneficio importante en una enfermedad que avanza a pasos de gigante.
El ensayo realizado en EE.UU y en el que participaron importantes instituciones como la Clínica Mayo o el Hospital General de Massachusetts también reflejó resultados semejantes: es una tecnología segura y que reporta beneficios terapéuticos.
El nuevo ensayo clínico, si confirma los resultados previos, puede convertirse en la llave que abra la puerta a la aprobación de esta terapia celular en el tratamiento de la esclerosis lateral amiotrófica.
También te puede interesar leer: ELA Bulbar: diagnóstico, síntomas y tratamiento.
Fuentes y referencias
Als Research Forum (2017): BrainStorm Launches Phase 3 ALS Clinical Trial in the US. Disponible en http://www.alsresearchforum.org/brainstorms-nurown-launches-phase-3-clinical-trial-in-the-us/
Brainstorm Cell Therapeutics (n.d): NurOwn® technology. Disponible en http://www.brainstorm-cell.com/assets/BCLI-Company-non-confidential-August-2017_website-v-2.pdf
Panayiota Petrou, Yael Gothelf, Zohar Argov, Marc Gotkine, Yossef S. Levy, Ibrahim Kassis, Adi Vaknin-Dembinsky, Tamir Ben-Hur, Daniel Offen, Oded Abramsky, et al. (2016): Safety and Clinical Effects of Mesenchymal Stem Cells Secreting Neurotrophic Factor Transplantation in Patients With Amyotrophic Lateral Sclerosis: Results of Phase 1/2 and 2a Clinical Trials. JAMA Neurol; 73(3): 337–344. doi: 10.1001/jamaneurol.2015.4321