La levodopa inhalada, que de ser aprobada por la FDA se comercializará bajo la marca de INBRIJA, tiene una forma de aplicación semejante a los medicamentos de inhalación oral para el asma. INBRIJA aspira a ser un tratamiento de rescate para las fluctuaciones motoras.
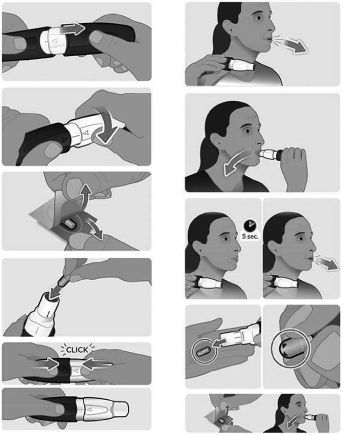
La compañía biotecnológica Acorda Therapeutics anunció recientemente que la FDA estadounidense ha aceptado evaluar su fármaco candidato a tratar los episodios OFF en la enfermedad de Párkinson.
De ser aprobado, el fármaco, conocido hasta ahora como CVT-301, saldría al mercado bajo la marca INBRIJA.
Es una formulación en polvo de levodopa que el enfermo de párkinson podrá autoadministrarse según lo necesite, igual que sucede con los fármacos para el asma.
La fecha máxima en que la FDA dará a conocer su decisión es el 5 octubre de 2018. Ya con anterioridad la compañía anunció su intención de solicitar la aprobación del regulador europeo.
También te puede interesar leer: Ensayo clínico encuentra beneficios del uso de levodopa inhalada para los periodos OFF de la enfermedad de Parkinson
¿Qué es exactamente INBRIJA?
INBRIJA, como ya adelantamos, es levodopa en polvo que se puede inhalar oralmente mediante un dispositivo diseñado por Acorda Therapeutics.
Esta vía de administración evita el paso por el sistema gastrointestinal, que demora la acción del fármaco.
INBRIJA es una terapia de rescate que el enfermo se autoadministra (todavía no se tienen detalles sobre la dosis diaria máxima aconsejada), además de mantener su tratamiento farmacológico habitual.
¿Quiénes podrían beneficiarse con INBRIJA?

INBRIJA no es un tratamiento para todos los enfermos, sino para aquellos que experimentan fluctuaciones motoras debido a que los medicamentos ya no resultan muy efectivos controlando los síntomas de la enfermedad.
Habitualmente las fluctuaciones motoras se convierten en un problema para los pacientes con varios años de evolución (entre 4 y 6 años) y que están fase avanzada de párkinson.
En opinión de Todd Sherer, CEO de la Fundación Michael J. Fox:
«Las personas con párkinson y los médicos necesitan más opciones para controlar esta enfermedad. La administración inhalada de levodopa podría ayudar a muchas personas que viven con párkinson a enfrentar la complicación de los periodos de ‘OFF’ a medida que progresa la enfermedad».
También te puede interesar leer: Levodopa para inhalar, nueva opción de tratamiento para episodios OFF en el párkinson, tiene buenas opciones de llegar al mercado
¿Qué se sabe sobre el efecto de INBRIJA?
Los ensayos clínicos realizados hasta el momento han hallado que INBRIJA comienza a hacer efecto a los 10 minutos de administrase y alcanza su máximo beneficio a los 30 minutos.
Este efecto parece mantenerse por al menos 60 minutos.
La mejoría en las escalas que miden los síntomas motores en el párkinson llegaron a ser de más de 10 puntos, lo que se considera un excelente resultado.
En relación a la seguridad destacan como eventos adversos más notables la tos, mareo, irritación de la garganta y nauseas.
INBRIJA parece tener todas las cartas para ganar el aprobado de la FDA, aunque en agosto del pasado año no aceptó la primera solicitud realizada por razones no relacionadas con los beneficios clínicos.
El fármaco no es un tratamiento curativo, tampoco una solución radical al problema de las fluctuaciones motoras, pero seguramente puede traer algo de alivio a miles de enfermos.
También te puede interesar leer: Todo sobre la discinesia en la enfermedad de Parkinson
Fuentes y referencias
Acorda Therapeutics (2017): Acorda Receives Refusal to File Letter from FDA for INBRIJA™ (CVT-301, levodopa inhalation powder) New Drug Application. En https://www.businesswire.com/news/home/20170829005411/en/Acorda-Receives-Refusal-File-Letter-FDA-INBRIJA%E2%84%A2
Acorda Therapeutics (2018): Acorda Announces FDA Acceptance of New Drug Application for INBRIJA™ (levodopa inhalation powder). En http://ir.acorda.com/investors/investor-news/investor-news-details/2018/Acorda-Announces-FDA-Acceptance-of-New-Drug-Application-for-INBRIJA-levodopa-inhalation-powder/default.aspx
Rachel, D (2018): Inhaled Levodopa for ‘Off’ Time Moves to FDA Review. En https://www.michaeljfox.org/mobile/news-detail.php?inhaled-levodopa-for-off-time-moves-to-fda-review